Unistat-Temperiersystem in der Atmosphärenforschung
Am Max-Planck-Institut für Chemie in Mainz wurden im Rahmen eines 10-jährigen Ozonforschungsprogramms des Bundesministeriums für Bildung und Forschung Laborexperimente zur polaren Stratosphärenforschung durchgeführt. Dabei kam auch ein Unistat 420w von Huber Kältemaschinenbau zum Einsatz. Unser Kunde Dr. Ulrich Krieger nimmt in diesem Beitrag Abschied von seinem Unistat-Temperiersystem, das ihn viele Jahre bei seiner Arbeit begleitet hat. Herzlichen Dank für den Gastbeitrag!
Autor: Dr. Ulrich Krieger, ETH Zürich – Institut für Atmosphäre und Klima
Lange Jahre hat der Unistat 420w mit der Seriennummer 28510/94 zuverlässig für uns gearbeitet; jetzt müssen wir uns von ihm trennen: Zeit für einen Rückblick auf die Geschichte des Temperiergerätes in der Atmosphärenforschung.

Die Entdeckung des Ozonloches über dem Südpol durch die Wissenschaftler Farman, Gardiner und Shanklin des British Antarctic Survey im Mai des Jahre 1985 – also vor genau 30 Jahren – kam auch für die Atmosphärenwissenschaftler völlig überraschend. Zwar hatten bereits in den 1970 Jahren Molina und Rowland postuliert, dass die Fluorkohlenwasserstoffe (FCKW), die einst als segensreiche Verbindungen den Einzug in Kältemaschinen, aber auch in Isolierschäume und Spraydosen gefunden hatten, aufgrund ihrer Reaktionsträgheit bis in die Stratosphäre aufsteigen und dort die Ozonschicht zerstören könnten, dennoch schockierte die Grösse der beobachteten Ozonzerstörung über den Polen die Wissenschaft. Die Entdeckung führte zu einer politischen Diskussion, die 1987 in das Montrealer Protokoll mündete, in dem erstmals konkrete Massnahmen für eine Reduktion der globalen FCKW-Emissionen verabredet wurden.
Zur Zeit der Unterzeichnung des Montrealer Protokolls war noch keineswegs ein wissenschaftlicher Konsens über die genauen Prozesse der polaren Ozonzerstörung erreicht. Aber bereits 1986 hatte Susan Solomon vorgeschlagen, dass chemische Reaktionen auf den Oberflächen polarer Stratosphärenwolken (sogenannte heterogene Reaktionen) in der kalten antarktischen Stratosphäre bei etwa -80 °C für eine Zunahme der Konzentrationen von sogenanntem „aktivem“ Chlor verantwortlich wären [1].
Weder war zu diesem Zeitpunkt klar, woraus die polaren Stratosphärenwolken eigentlich bestehen, noch ob die von Solomon et al. vorgeschlagene Reaktion der Chloraktivierung, nämlich der Verlust von Chlornitrat in der Gasphase (g) mit an der Oberfläche adsorbiertem oder gelösten Chlorwasserstoff (s)
die entscheidende heterogene Reaktion ist, welche zu gasförmigem Chlor führt, das dann wiederum photolysiert werden kann und nachfolgend katalytisch das Ozon zerstört. Solomon et al. schrieben: „Reaction (1) is certainly very speculative… the lack of direct laboratory data regarding the kinetics and mechanisms of reaction (1)…“.
Und hier kommt der Unistat 420w ins Spiel. Im Gegensatz zu den uns vertrauten Wolken in der Troposphäre entstehen Wolken in der Stratosphäre – wie in Abbildung 1 gezeigt – aufgrund der dort vorherrschenden Trockenheit nur unter sehr kalten Bedingungen bei Temperaturen unterhalb von -70 °C. Laborexperimente zur Entstehung und Chemie der polaren Stratosphärenwolken müssen also bei Temperaturen von -70 °C bis ca. -90 °C durchgeführt werden, dabei müssen diese Temperaturen genau angefahren werden können und für längere Zeiten, nämlich bis zu einigen Tagen, stabil gehalten werden. Diese Wolken können nicht nur aus Wassereis bestehen, sondern auch aus Hydraten der Salpetersäure oder der Schwefelsäure, sowie als unterkühlte ternäre Lösungströpfchen aus Schwefelsäure, Salpetersäure und Wasser bestehen, siehe Abbildung 2.
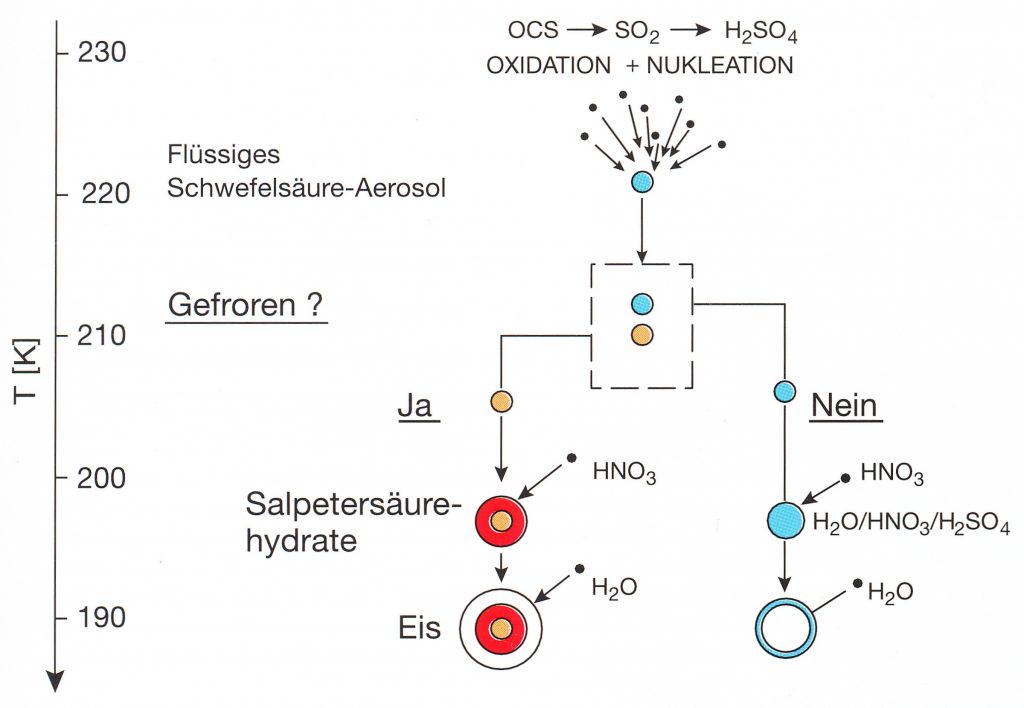
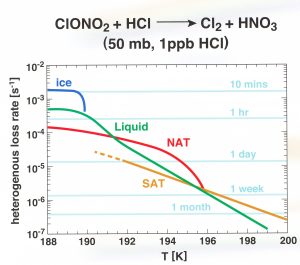
Warum ist die genaue Zusammensetzung dieser Wolkenteilchen überhaupt von grundlegender Bedeutung? Die Verlustrate von Chlornitrat (Gleichung 1) hängt nicht nur von der Temperatur, sondern auch von der Zusammensetzung der Oberfläche ab wie in Abbildung 3 gezeigt.
Am Max-Planck-Institut für Chemie in Mainz haben wir im Rahmen des 10-jährigen Ozonforschungsprogramms des Bundesministeriums für Bildung und Forschung [2] Laborexperimente zur Bildung und Chemie polarer Stratosphärenforschung durchgeführt; auf eines dieser Experimente sei im Folgenden etwas genauer eingegangen.
Einzelne Aerosolteichen mit Durchmessern von nur wenigen Mikrometern lassen sich unter kontrollierten Umgebungsbedingungen über lange Zeiträume ortsfest in der Schwebe halten, im in der Abbildung 4 gezeigten Aufbau wird dies in einer elektrodynamischen Falle realisiert. Diese Aerosolteilchen lassen sich dann mit Hilfe spektroskopischer Methoden in Bezug auf ihre Grösse, ihren Aggregatzustand, ihre optischen Eigenschaften und ihre chemische Zusammensetzung untersuchen, ohne dass diese Eigenschaften durch einen Kontakt zu einer Oberfläche verfälscht werden.
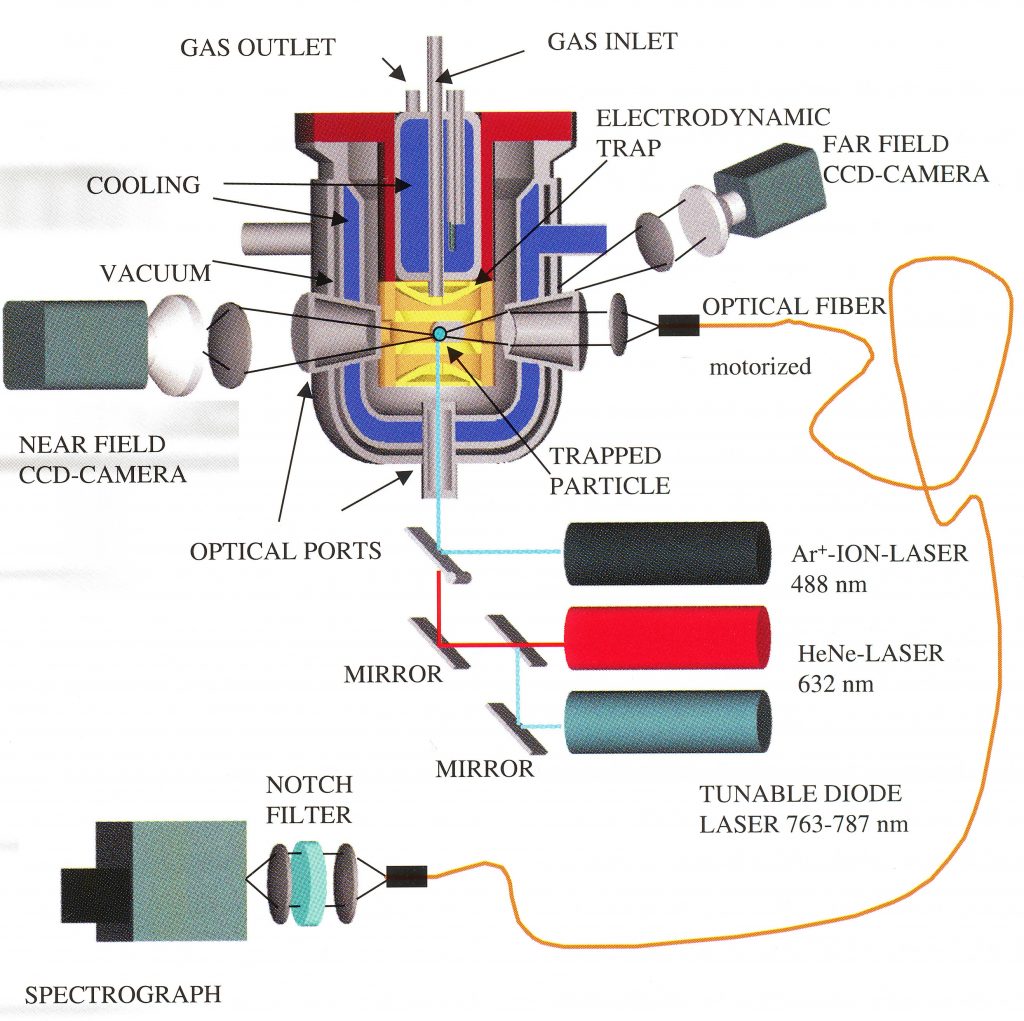
Wie oben schon erwähnt, ist es für diese Experimente unbedingt erforderlich, eine homogene Temperaturverteilung bei Temperaturen bis unter -100 °C für längere Zeiten präzise zu gewährleisten. Hier befand sich die elektrodynamische Falle in einer dreiwandigen Glaskammer mit einem Isoliervakuum in der äusseren Wand, die innere Wand sowie die zugeführte Gasphase wurde mit dem Unistat 420w mit Methylcyclohexan als Temperierflüssigkeit auf die erforderliche Temperatur gekühlt. Wir konnten zeigen, dass sich Schwefelsäuretröpfchen über einen weiten Konzentrationsbereich bis weit unter die thermodynamischen Koexistenztemperaturen unterkühlen lasse. Selbst bei einer Temperatur von 158 K, d.h. -115 °C, wurde über einen Zeitraum von 24 Stunden kein Gefrieren der Tröpfchen beobachtet [3].
Die Kältemaschine wurde nach diesen Experimente über weitere 10 Jahre in diesem Aufbau für unterschiedliche Projekte an der Eidgenössischen Technischen Hochschule (ETH) Zürich erfolgreich gebraucht, zuletzt zur Bestimmung von Diffusionskonstanten in organischen Aerosolen bei tiefen Temperaturen. Nach mehr als 20 Jahren Betriebsdauer stand bei dem Unistat ein Austausch des Kältemittel an. Dieser hätte es zwingend erforderlich gemacht, auf ein anderes, zugelassenes Kältemittel umzurüsten – diese Maßnahme wäre aus wirtschaftlicher Sicht jedoch unrentabel gewesen.
Es mag eine Ironie der Geschichte sein, dass gerade der Forschungsgegenstand, im Rahmen derer der Unistat genutzt wurde, eine Weiternutzung wirtschaftlich unrentabel gemacht hat. Umso mehr dürfen wir zufrieden feststellen, dass die heutigen Unistate mit natürlichen Kältemitteln arbeiten, die umweltfreundlicher sind als diejenigen, die zur Zeit des Ozonforschungsprogrammes verwendet wurden.
Referenzen:
[1] Salomon, S., Garcia, R. R., Rowland, F. S., and Wuebbles, D. J.,: „On the depletion of Antarctic ozone“, Nature, 321, 755 – 758 (1986).
[2] Zellner, R., Peter, Th., Dämmer, K. und Quintern, L.: „10 Jahre Deutsche Ozonforschung“, Dokumentation des Ozonforschungsprogrammes des BMBF (1999).
[3] Krieger, U. K., Colberg, C. A., Weers, U., Koop, T., and Peter, Th.: „Supercooling of single H2SO4/H2O aerosols to 158 K: No evidence for the occurrence of the octahydrate“, Geophysical Research Letters, 27, 2097 – 2100 (2000).


